2019年6月18日,美國微生物學會(ASM)旗下頂級刊物mBio在線發(fā)表了中國農(nóng)業(yè)科學院哈爾濱獸醫(yī)研究所國家禽流感參考實驗室題為“Low polymerase activity attributed to PA drives the acquisition of the PB2 E627K mutation of H7N9 avian influenza virus in mammals”的研究成果����,研究團隊在H7N9禽流感病毒適應(yīng)哺乳動物宿主機制研究方面取得重要進展,揭示了H7N9禽流感病毒PA蛋白所導致的病毒在哺乳動物細胞上的低聚合酶活性是使其在小鼠體內(nèi)復制過程中發(fā)生PB2/E627K突變的內(nèi)在驅(qū)動力�����。

自2013年H7N9流感病毒在我國出現(xiàn)后,目前已造成1568人感染��,死亡率接近40%�。禽流感病毒需要獲得哺乳動物適應(yīng)性突變后才能在人體內(nèi)有效地復制和傳播。早在1993年����,美國科學家就發(fā)現(xiàn)流感病毒在哺乳動物細胞中復制時會在病毒聚合酶蛋白PB2上發(fā)生E627K突變,但該突變產(chǎn)生的機制26年來一直是未解之謎��。
1.不同禽流感病毒在MDCK細胞和小鼠中獲得PB2 E627K突變的能力不同���。
研究團隊前期發(fā)現(xiàn)PB2/E627K突變是H7N9流感病毒對人致病力增強的關(guān)鍵���,同時該突變增加H7N9病毒在人之間的傳播能力。為了研究H7N9和H9N2在哺乳動物宿主復制過程中是否具有相同的獲得PB2 E627K突變的能力���,研究者首先選擇了1株H7N9禽流感病毒株A/pigeon/Shanghai/S1421/2013[PG/S1421(H7N9)和5株H9N2禽流感病毒株在MDCK細胞中傳代�����。結(jié)果發(fā)現(xiàn)不同禽流感病毒在MDCK細胞和小鼠復制過程中獲得PB2 E627K突變的能力不同(表1)�。
2. PA的低聚合酶活性導致了哺乳動物適應(yīng)性PB2 E627K突變的出現(xiàn)����。
在此基礎(chǔ)上,研究團隊以PG/S1421(H7N9)作為骨架下構(gòu)建了一系列重組及突變病毒����,每個重組病毒包含一個來自CK/5(H9N2)的基因片段,將獲得的系列重組病毒感染小鼠���,結(jié)合小鼠體內(nèi)的病毒復制情況以及測序分析以便監(jiān)測其PB2/E627K突變發(fā)生情況���,結(jié)果發(fā)現(xiàn),只有當PG/S1421(H7N9)的PA替換成H9N2的PA基因時��,小鼠體內(nèi)分離得到的病毒才會出現(xiàn)PB2/E627K突變(圖1)��。進一步的�,研究揭示了H7N9禽流感病毒PA蛋白所導致的病毒在哺乳動物細胞上的低聚合酶活性是使其在小鼠體內(nèi)復制過程中發(fā)生PB2/E627K突變的內(nèi)在驅(qū)動力。
圖1.PA基因低聚合酶活性驅(qū)動了其在小鼠體內(nèi)發(fā)生PB2 E627K突變3. PA基因N端的4個氨基酸殘基對其在小鼠體內(nèi)發(fā)生PB2 E627K突變P起著重要的調(diào)節(jié)作用為了探索介導H7N9流感病毒PB2 E627K突變的PG/S1421(H7N9) PA的特異結(jié)構(gòu)域�����,研究者構(gòu)建了兩個PA嵌合體�,其中PG/S1421(H7N9) PA的結(jié)構(gòu)域1-252或253-716被CK/5(H9N2) PA取代(圖2A)。包含CK/5(H9N2) PA結(jié)構(gòu)域1-252的RNP組合(在293T細胞中,7PB27PB179(1–252)PA7NP的聚合酶活性明顯高于7PB27PB17PA7NP��,而含有CK/5(H9N2) PA結(jié)構(gòu)域253-716的RNP組合(即, 7PB27PB179(253-716)PA7NP與7PB27PB17PA7NP一樣低(圖2B)���。小鼠體內(nèi)感染研究結(jié)果顯示�,含有CK/5(H9N2) PA結(jié)構(gòu)域1-252的嵌合PA病毒在小鼠中復制�����,但未獲得PB2 E627K突變���;相比之下�,CK/5(H9N2) PA的嵌合型PA病毒在小鼠復制過程中獲得了PB2 E627K突變(圖2C)����。這些結(jié)果表明,在H7N9病毒在哺乳動物宿主復制過程中����,PA (PAN)的N端1-252結(jié)構(gòu)域在介導PB2 E627K取代的獲得過程中起關(guān)鍵作用。
進一步的�,研究者以PG/S1421(H7N9) 構(gòu)建了另外四個PA嵌合體,分別嵌合了CK/5(H9N2) PA的1-60���、1-86�、1-120、1-191���,以確定PAN中決定PB2 E627K突變發(fā)生的關(guān)鍵區(qū)域。研究發(fā)現(xiàn)�����,PG/S1421(H7N9)和CK/5(H9N2)的PA蛋白在在121-191區(qū)僅存在142r��、147V����、171V和182l四個殘基的差異,四種殘基組合增加的聚合酶活性最大�。更換四個PA殘留物(142K, 147I, 171I,和182M)PG / S1421 (H7N9)與CK / 5 (H9N2) (142 R, 147V��、171V和182l)可提高聚合酶活性能夠消除其在小鼠獲得PB2 E627K突變����。以A/chicken/Guangdong/SD008/2017 [CK/ SD008(H7N9)]。此外�,研究發(fā)現(xiàn),這四個殘基142K����、147I���、171I和182M在不同亞型AIVs的PA蛋白中高度保守,這表明它們在哺乳動物AIVs的適應(yīng)性中可能具有廣泛的作用����。
圖2.PA基因N端的4個氨基酸殘基對其在小鼠體內(nèi)發(fā)生PB2 E627K突變P起著重要的調(diào)節(jié)作用
圖3 嵌合或突變體PA替代H7N9 PA可增強A549細胞病毒基因組的轉(zhuǎn)錄和復制
4.PA蛋白決定H7N9禽流感病毒在哺乳動物細胞上的聚合酶活性和復制依賴于宿主因子ANP32A另一方面,本研究還發(fā)現(xiàn)H7N9禽流感病毒在哺乳動物細胞上的復制能力高度依賴于宿主因子ANP32A蛋白的表達����,當Anp32a基因在小鼠體內(nèi)被敲除后則使H7N9病毒在復制過程中失去了獲得PB2/E627K突變的能力,而采取了另外一種適應(yīng)哺乳動物宿主的方式��,即獲得PB2/D701N突變�。
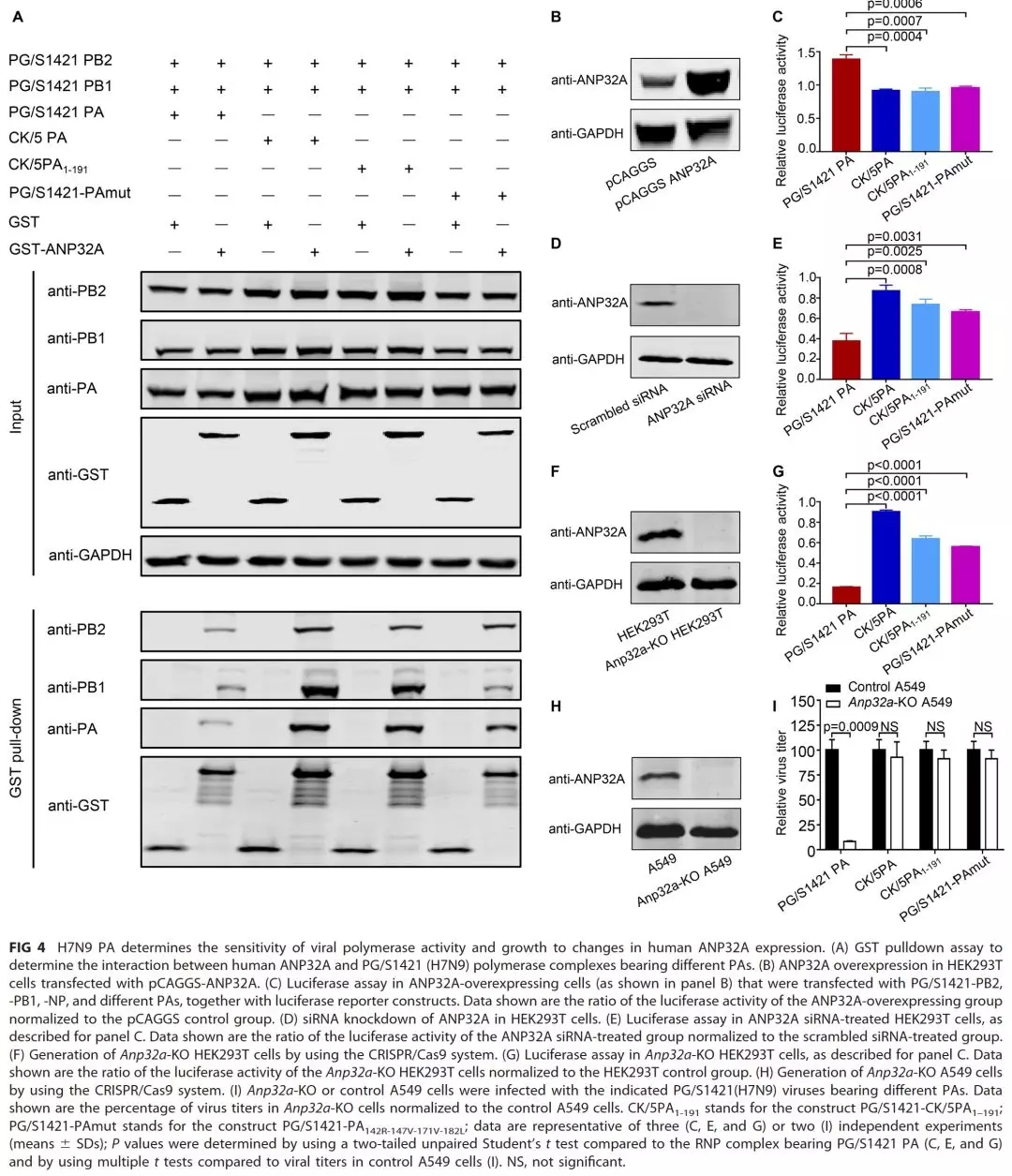
圖4.PA蛋白決定H7N9禽流感病毒在哺乳動物細胞上的聚合酶活性和復制依賴于宿主因子ANP32A該研究從病毒本身“內(nèi)因”及宿主“外因”兩方面,深入闡釋了H7N9禽流感病毒感染人后迅速獲得PB2/E627K突變而導致病毒對人類宿主適應(yīng)能力和致病力增強的分子機制�,從而為深入理解禽流感病毒如何適應(yīng)哺乳動物宿主及跨種感染和傳播這一重要科學問題做出了貢獻。
陳化蘭院士團隊梁立濱博士����、姜麗研究員為文章共同第一作者,本研究得到了國家重點研發(fā)計劃(2016YFD0500205)�����、國家自然科學基金優(yōu)秀青年科學基金(31422054)和國家自然科學基金創(chuàng)新研究群體(31521005)等項目資助。
ABSTRACT
Avian influenzaviruses (AIVs) must acquire mammalian-adaptive mutations before they canefficiently replicate in and transmit among humans. The PB2 E627K mutation is known to play a prominent role in the mammalian adaptation of AIVs. The H7N9 AIVs that emerged in 2013 in China easily acquired the PB2 E627K mutation upon replication in humans. Here, we generate a series of reassortant or mutant H7N9 AIVs and test them in mice. We show that the low polymerase activity attributed to the viral PA protein is the intrinsic driving force behind the emergence ofPB2 E627K during H7N9 AIV replication in mice. Four residues in the N-terminal region of PA are critical in mediating the PB2 E627K acquisition. Notably, due to the identity of viral PA protein, the polymerase activity and growth of H7N9 AIV are highly sensitive to changes in expression levels of human ANP32A protein. Furthermore, the impaired viral polymerase activity of H7N9 AIV caused by the depletion of ANP32A led to reduced virus replication in Anp32a?/? mice, abolishing the acquisition of the PB2 E627K mutation and instead driving the virus to acquire the alternative PB2 D701N mutation. Taken together, our findings show that the emergence of the PB2 E627K mutation of H7N9 AIV is driven by the intrinsic low polymerase activity conferred by the viral PA protein, which also involves the engagement of mammalian ANP32A.
來源:哈獸研